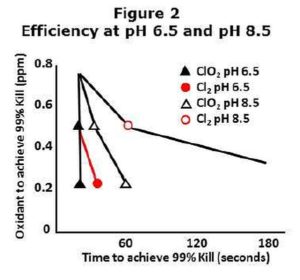
A klór főként az „elpusztítás sebességével” összefüggésben lévő hatékonysága, pH függő, amely magasabb pH-s vízben, általában lúgos vízben, lassabb és magasabb koncentrációt igényel. A klórdioxid ugyanolyan hatásfokú széles pH skálán 4-10 terjedő pH értékek között. Ezt értelmezhetjük úgy, hogy lúgos vízben, illetve 7,5 körüli pH fölött a klórdioxid jobb, hatékonyabb biocid mint a klór. Ez nem azt jelenti, hogy a klór ne működne magas pH-jú vízben, csak azt, hogy ami az „elpusztítás sebességét” illeti, jóval kevésbé hatékony.
Ennek oka, hogy a klór a vízben hidrolizál, és a hidrolízis termék, a hipoklórossav (HOCl) hipoklorit ionokká (OCl-) bomlik szét. A hipoklórossav és a hipoklorit ionok egyensúlyi állapotban vannak, az egyensúlyi reakció, (ii) egyenlet, a pH emelkedésével jobbra tolódik, azaz a hipoklorit ion koncentrációja megnövekedik.
Cl2 + H2O → HOCl + HCl ………………………. (ia)
NaOCl + H2O → HOCl + NaOH ……………………. (ib)
HOCl ⇄ H+ + OCl- …………………………………………………… (ii)
A klórdioxid a klórdioxid gáz oldata vízben és nem hidrolizál.
